
一种基于核-壳结构的水凝胶胶囊,用于分离CSCs。
Introduction
CSCs可以基于表面标记物来分离,如CD44、CD133、CD24、上皮细胞粘附分子(EpCAM)、乙醛脱氢酶1(ALDH1)和三磷酸腺苷(ATP)结合盒B5(ABCB5)。这种方法经常导致困惑,因为两种或多种表面标记物已经在不同研究里用于从同种癌症类型中鉴定CSCs,然而在被选择的CSCs中,不同表面标记物的共表达却极为有限。
另一种广泛应用的方法是在不含血清的明确的CSC培养基中进行悬浮培养。尽管悬滴法、旋转和转瓶法、NASA旋转细胞培养系统被开发通过悬浮培养来富集CSCs,超低附着板(ULAPs)是最常用于悬浮富集各种类型的癌症CSCs。
作者使用了人三阴性乳腺癌细胞MDA-MB-231、前列腺癌细胞PC-3、人HER2^+^乳腺癌细胞MCF-7和人卵巢癌细胞OVCAR-8。通过ULAP法以1~20000个细胞每孔的密度培养这4种细胞系,发现有超过90%的细胞能够在悬浮环境下长成聚集体或球体,暗示基于非CSC细胞的失巢凋亡的理论可能存疑。因此作者提出需要开发一种可靠的无标签的CSC分离方法。
Figure 1. The bioinspired one single cell microencapsulation for isolation and culture of cancer stem cells (CSCs)
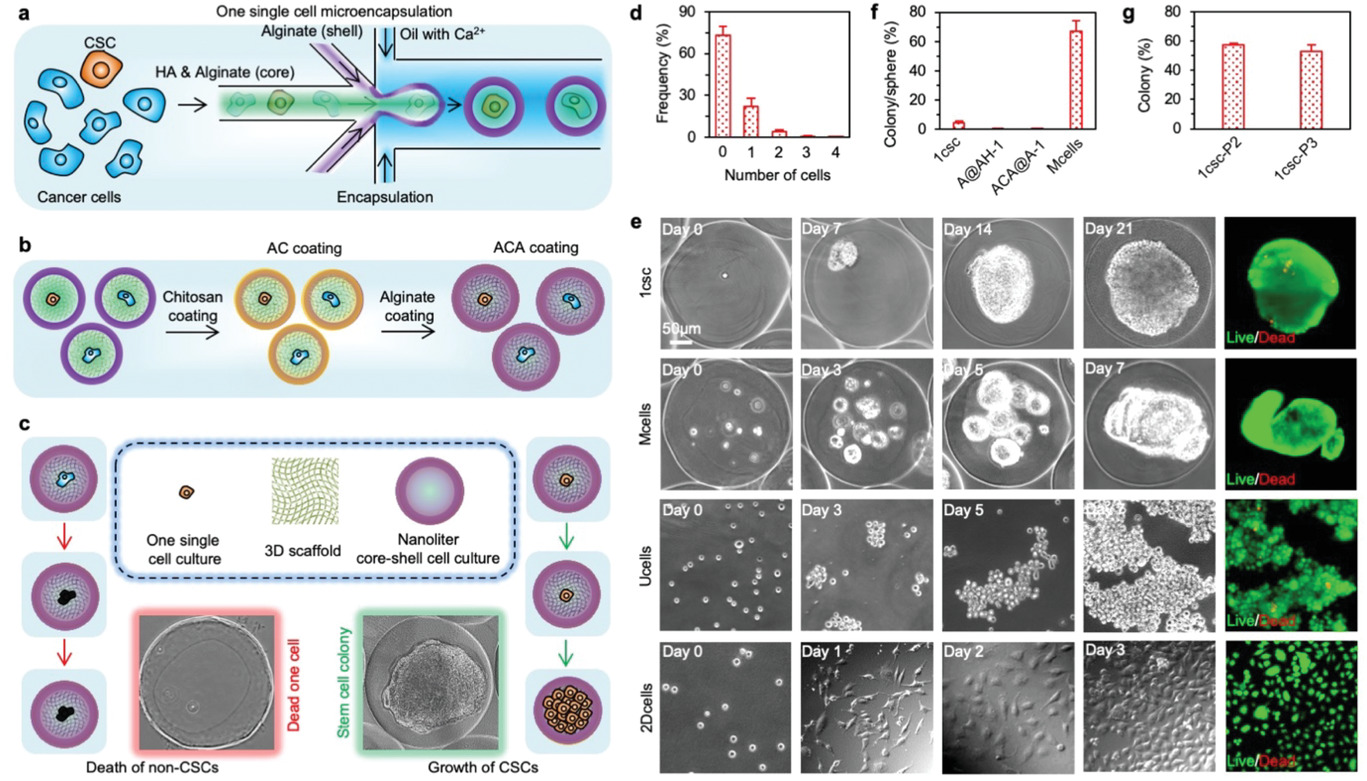
- (a)使用非平面微流控系统生成一个单细胞微胶囊的示意图。海藻酸(Alginate, A)和透明质酸(hyaluronan, HA/H)用于形成AH核框架与海藻酸水凝胶壳。单细胞位于核-壳结构微胶囊的核中。
- (b)为了保持HA(H)在核-壳结构微胶囊,先将海藻酸(A)壳用壳聚糖(chitosan, C)包裹,随后海藻酸(A)通过静电作用力形成ACA覆盖表面,最终形成ACA@AH核-壳结构微胶囊。
- (c)一个单细胞微胶囊用于分离和在确定的CSC培养基中培养CSC的示意图:只有CSCs可以在微型的核-壳结构微胶囊的3D AH核框架中生存和增殖,而非CSC会因为失巢凋亡而死亡。。。
- (d)柱状图展示了微流控包装后的空胶囊和1-4个细胞的微胶囊的分布。
- (e)典型的显微图片显示了:
- 一个单MDA-MB-231人三阴性乳腺癌细胞在ACA包裹的核-壳结构微胶囊中的HA(H)核(ACA@AH-1 或 1csc)。
- 多个MDA-MB-231细胞(10-15个细胞每胶囊)在ACA包裹的核-壳结构中的HA(H)核(Mcells)。
- MDA-MB-231细胞在传统超低附着板上悬浮培养(Ucells)。
- MDA-MB-231细胞2D培养(2Dcells)。
- (f)大约4.4%的MDA-MB-231细胞可以在1csc(ACA@AH-1)培养下形成集落。不管是没有ACA包裹但在核中有HA的核-壳结构微胶囊(A@AH-1)中还是有ACA包裹但核中没有HA(ACA@A-1),几乎没有一个MDA-MB-231细胞可以存活。然而,7天培养后细胞球可以在大多数有多个MDA-MB-231的ACA@AC微胶囊中看到。MDA-MB-231细胞在Ucells培养7天会形成松散的聚集物,而2D培养下3天,细胞会贴壁增殖到~80-90的汇合度。
- (g)连续传代实验表明,超过50%的1csc集落的细胞,可以在1csc培养下产生新的集落。第一代1csc(1csc-P1)和e、f中的1csc组一样,1csc-P2和1csc-P3代表第二代和第三代1csc培养,分别来自于1csc-P1和1csc-P2集落的分离的单细胞。
这里ACA是为了防止HA扩散到胶囊外。
海藻酸是聚阴离子电解质,壳聚糖是聚阳离子,聚阴离子和聚阳离子能够通过静电作用形成聚电解质复合物。
海藻酸-壳聚糖-海藻酸微胶囊是一种具有聚电解质络合物结构为囊膜和海藻酸钠为囊芯物的微胶囊,其中,微胶囊囊膜具有合适的孔径,能够有效阻止囊芯物海藻酸钠向囊外扩散,从而使其固定在囊内。
参考文献。
Figure 2. Characterization of stemness with gene and protein expressions
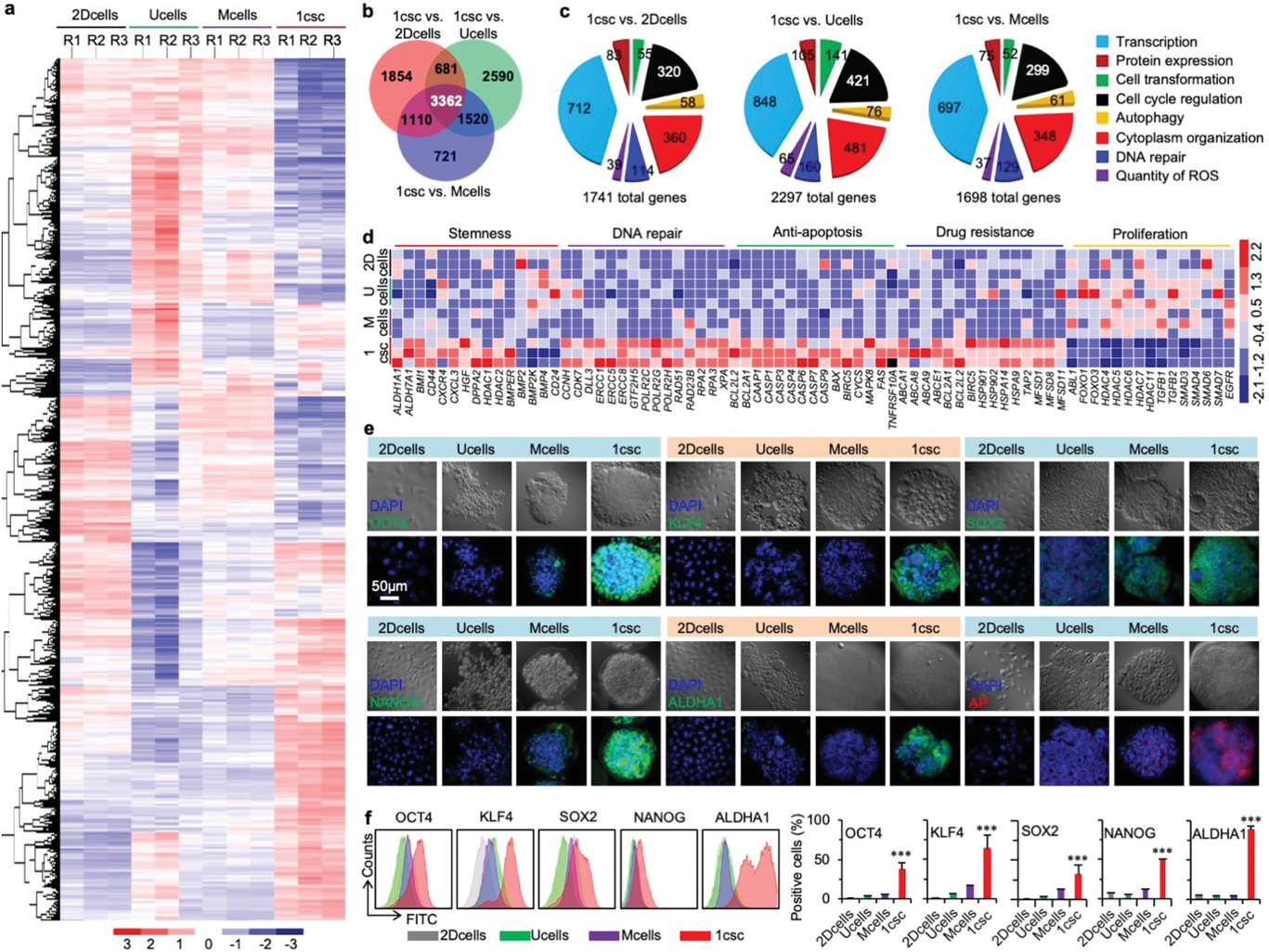
- (a)从2DCells、Ucells、Mcells和1csc培养中获得细胞的RNA测序(RNA-Seq)的差异基因表达热图,显示了1csc组的基因表达和其他3组差异更大。
- (b)2DCells、Ucells、Mcells和1csc组的差异基因表达热图的Venn图。
- (c)1csc vs. 2Dcells、Ucells和Mcells得到的显著改变基因的基因本体论(Gene ontology, GO)富集分析。全基因组数据来自3次独立实验。
- (d)2DCells、Ucells、Mcells和1csc组关于干性(包括4种下调差异标记物基因)、DNA修复、抗凋亡、药物抵抗和细胞增殖的基因表达热图。
- (e)2DCells、Ucells、Mcells和1csc组的OCT4、KLF4、SOX2、NANOG、ALDHA1和AP(alkaline phosphatase, 碱性磷酸酶)蛋白表达的共聚焦图像。核用DAPI染色。
- (f)2DCells、Ucells、Mcells和1csc组的OCT4、KLF4、SOX2、NANOG和ALDHA1的代表性的流式细胞术峰和定量分析。
CSC静止,是一种细胞对抗细胞毒素治疗的假说。因此增殖基因如ABL1、FOXO1和FOXO3下调。
OCT4(八聚体结合转录因子4)、KLF4、SOX2和NANOG,对维持多能性十分关键,从基因表达分析上发现没有在1csc组上调,然而通过共聚焦显微图像和流式细胞术发现表达量增加。可能是因为mRNAs转化为蛋白质的过程受到细胞中许多转录后过程的调控。
ALDHA1和AP,干性的通用标记物,同样出现高表达。
Figure 3. Characterization of stemness with cross-tissue multilineage differentiation

- (a)内皮分化和血管形成的流程示意图。
- (b)培养在补充有50 ng mL^-1^的血管内皮生长因子(VEGF)的内皮生长培养基(EGM)2DCells、Ucells、Mcells和1csc组,以及培养在CSC培养基的1csc组的细胞的人CD31(hCD31)和肌动蛋白(ACTIN)的免疫荧光染色及细胞核的DAPI染色。DIC指:Differential interference contrast, 微分干涉差(显微镜)。
- (c)心肌分化的流程示意图。
- (d, e)共聚焦图像显示各组心肌分化后的2种心肌特异性标记物的表达水平,d图为心肌肌钙蛋白I(cardiac troponin I, cTnI),e图为α-肌动蛋白(𝛼-ACTININ)。
- (f)成骨分化的流程示意图。
- (g)用茜素红S(Alizarin Red S)染色的细胞典型图片和显微镜图像,以观察成骨分化后的钙沉积。
- (h)定量分析2Dcells、Ucells、Mcells和1csc组成骨分化后细胞中茜素红S在500 nm处的吸光度。
- (i)神经分化的流程示意图,共聚焦图像显示四个组分化细胞的神经特异性标记物MUSASHI-1(MUS)和神经突的形成。细胞核由DAPI染色,微管蛋白(TUBULIN, TUB)被染色以显示细胞骨架。
应用茜素红溶液对成骨细胞染色,茜素红可与钙离子螯合,产生深红色或紫红色的复合物,可用于鉴定干细胞是否已成功向成骨细胞分化。
Figure 4. Characterization of stemness with multi-generation tumorigenesis assay in vivo

- (a)三代(G1-G3)体内致瘤实验的示意图。
- G1肿瘤来自2DCells、Ucells、Mcells和1csc培养的MDA-MB-231细胞。
- G2肿瘤来自1csc培养的4种类型的G1肿瘤细胞。
- G3肿瘤来自1csc培养的4种类型的G2肿瘤细胞。
- (b, c)b图为55天的G1肿瘤(2D、U、M和1)个体生长曲线;c图为55天的G1肿瘤重量。
- (d)RNA-Seq分析获得的来自体外1csc的注射前组(in vitro)和肿瘤细胞组(in vivo)的不同的基因表达差异热图。
- (e)来自1csc组的体内细胞(in vivo)与体外细胞(in vitro)的上调和下调基因的分布。
- (f)来自1csc组的体内细胞与体外细胞的显著改变基因的通路分析。全基因组数据来自3次独立实验。
- (g)来自1csc组的体内细胞与体外细胞以及体外2D培养细胞(2Dcells)关于干性(阳性和阴性)、DNA修复、抗凋亡、药物抵抗和细胞增殖的基因表达热图。1csc组的体内细胞的基因表达更接近于2Dcells组而不是1csc组的体外细胞。
- (h, i)h图为55天的G2肿瘤(2D-1、U-1、M-1和1-1)个体生长曲线;i图为55天的G2肿瘤重量。
- (j, k)j图为55天的G3肿瘤(2D-1-1、U-1-1、M-1-1和1-1-1)个体生长曲线;k图为55天的G3肿瘤重量。
- (l)来自于2Dcells、Ucells和Mcells培养的1csc的G1肿瘤细胞产生G2肿瘤的描述图,右边为个体生长曲线(1-2D、1-U和1-M)。
- (m)55天的1-2D、1-U和1-M肿瘤重量。
- (n)来自于2Dcells、Ucells和Mcells培养的1csc的G2肿瘤细胞产生三代肿瘤的描述图,右边为个体生长曲线(1-1-2D、1-1-U和1-1-M)。
- (o)55天的1-1-2D、1-1-U和1-1-M肿瘤重量。TF:55天时肿瘤在小鼠内形成。
Figure 5. Characterization of stemness with metastasis assay in vivo

- (a)转移实验的流程示意图。来自2DCells、Ucells、Mcells和1csc的细胞被用于从小鼠尾静脉注射,相关转移研究组被分别称为2Dmeta、Umeta、Mmeta和1meta。
- (b, c)b为布安溶液(Bouin solution)固定的肺的代表性相片。c为2Dmeta、Umeta、Mmeta和1meta组固定之前的肺重量。
- (d)典型的2Dmeta、Umeta、Mmeta和1meta组的肺组织H&E染色,箭头所指显示了1meta组的肺部转移。
- (e)在H&E切片中观察到的转移性肿瘤的定量分析。
- (f)2Dmeta、Umeta、Mmeta和1meta组肺组织的代表性荧光图像。对CD44和Ki-67进行免疫荧光染色。仅在1meta组可以看到CD44和Ki-67。
CD44与细胞自我更新有关;Ki-67与细胞增殖相关。
Figure 6. Implications for developing CSC-targeted therapeutic strategies
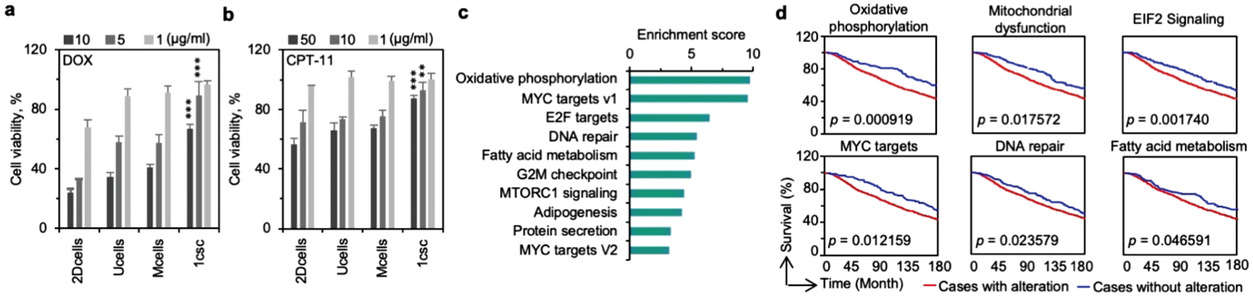
- (a, b)来自2DCells、Ucells、Mcells和1csc培养的MDA-MB-231细胞,分别使用盐酸阿霉素(doxorubicin hydrochloride, DOX)和喜树碱11(camptothecin-11, CPT-11)的细胞活性。
- (c)1csc集落细胞和2DCells、Ucells、Mcells相比的信号通路的基因集富集分析(Gene set enrichment analysis, GSEA)。
- (d)富集的关键基因包括氧化磷酸化(oxidative phosphorylation)、线粒体功能障碍(mitochondrial dysfunction)、真核起始因子2信号(EIF2 signaling)、MYC靶点(MYC targets)、DNA修复(DNA repair)和脂肪酸代谢途径(fatty acid metabolism pathways)(红线表示)的全部生存曲线通过Kaplan–Meier法估计。蓝线展示了没有富集相关通路的病人生存曲线。
Conclusion
对我可能用得上的结论:
- 透明质酸对CSC生存和形成集落十分关键。
- CSCs大约占癌症细胞群数量的3~5%。
作者提出和其他研究可能冲突的:
- 基因组分析表明,这种水凝胶方法获得的细胞集落和其他方式获得的有较大差异,包括悬浮培养法。
Reference
Wang H, Agarwal P, Jiang B, et al. Bioinspired One Cell Culture Isolates Highly Tumorigenic and Metastatic Cancer Stem Cells Capable of Multilineage Differentiation[J]. Advanced Science, 2020, 7(11): 2000259.



